01-02-2023 23:31 Продолжаю в химию
Итак, самое важное, чем один элемент отличается от другого - насколько заполнена его самая далекая от ядра орбиталь (она же называется внешним электронным уровнем).
Когда два атома поменялись электронами, то есть электроны одного находятся на орбитах вокруг ядра другого (при этом одновременно продолжая крутиться и вокруг ядра первого) - они среагировали друг с другом.
Любой элемент стремится забить незаполненный уровень чужими электронами, или наоборот отдать лишние свои. Я так понял, что если уровень забит меньше чем на половину - это можно воспринимать как "выступ в детальке паззла", то есть атом пытается присоединить лишние элементы в систему другого (такой атом называется донором). Если уровень забит больше чем на половину - то это "выемка в паззлинке" которую атом пытается заполнить чужими электронами (атом называется акцептором). Лучше всего реагируют атомы, выступы и выемки которых подходят друг к другу.
Чем уровень ближе к ядру - тем ядро сильнее держит электроны на нем, но одновременно тем сильнее пытается восполнить недостающие электроны.
В таблице Менделеева - первые два столбца это атомы доноры. Причем чем выше строка тем слабее донор.
3-5 столбцы это ни рыба ни мясо. Чем выше строка тем скорее акцептор, чем ниже - тем скорее донор.
6-7 атомы акцепторы. Чем выше строка тем сильнее акцептор.
8 столбец - атомы у которых полностью забит последний уровень, то есть они не желают вообще ни с кем реагировать.
(На самом деле не совсем, там ниже по тексту у меня более точный рисунок.)
Вещества из одного и того же столбца в целом похожи по поведению, но чем ниже они тем менее стабильны.
Таким образом самый стабильный элемент это гелий, самый яростный акцептор это фтор, а самые яростные доноры это все снизу списка.
Окей. Далее.
При нагреве вещества - его электроны ненадолго улетают на более далекие орбиты вокруг ядра...
(На самом деле не улетают а телепортируются, и вообще электрон не умеет двигаться он только и делает что телепортируется туда-сюда и вообще находится одновременно во всех вероятных точках своей орбиты и плюс еще вообще где угодно в мире но с меньшей вероятностью) - но это все квантовая механика, ее игнорируем.
Так вот - при нагреве электроны улетают на более далекие орбиты, и потом при остывании испускают свет (лишаясь энергии) и возвращаются на более близкие. Это фактически происходит при полураспаде радиоактивных веществ. Этот же процесс мы видим при нагревании металла - поэтому он светится - это электроны возвращаются с далеких орбит на ближние.
Видимый нашим глазом свет возникает при сваливании электронов с 5, 4 и 3 уровней на второй. При сваливании электронов на первый уровень - возникает более мощный ультрафиолетовый свет. При сваливании на третий - более слабый свет, при сваливании на четвертый - еще более слабый и т.д. (впрочем на четвертый уже почти ничего не сваливается, т.к. он далеко от ядра, и до него притяжение ядра доходит едва-едва).
Общий смысл химических реакций в том, что мы нагреваем вещество, и в результате выбиваем его электроны на более далекие орбиты (либо вообще выбиваем их куда подальше от атома). В далее когда электроны сваливаются назад - на свободные места вместо "своих" электронов (а так же вместе со своими электронами), могут упасть электроны, которые уже "прицеплены" к другому рядом пролетающему атому. Таким образом несколько атомов сцепятся в молекулу.
Если из атома вообще выбит один или несколько электронов, и вместо них ничего не свалилось, то есть места вообще вакантны - атом называется ионом. И тогда он начинает активно искать, чем бы забить недостающее место.
Энергия, необходимая, чтобы превратить атом в ион (то есть выбить нафиг его электроны) - называется энергией ионизации.
-
Далее небольшой отскок назад - к клеточкам.
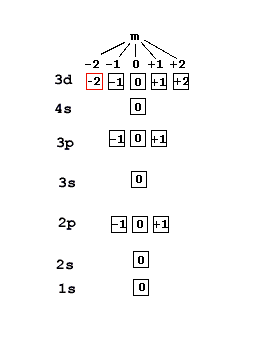
Как говорилось ранее, каждая клеточка это два электрона. Если клеточки на любой строке забиты электронами целиком - то реагировать такое вещество вообще ни с кем не хочет и заставить его тяжело (высокая энергия ионизации).
Если забита только первая клетка из пяти - это значит магнитное квантовое число -2. Если только первая клетка из трех - число -1. Если третья клетка из пяти - число 0.
Чем магнитное число меньше - тем сильнее атом пытается отдать лишние электроны. Чем оно больше - тем сильнее он пытается притянуть недостающие электроны, чтобы получить себе полностью забитый электронами этаж. Точнее здесь по этой картинке получается что атом пытается получить полузабитые этажи... вобщем не важно, потом буду разбираться.
Далее спин. Условно считается что спин это вращение электрона, но опять же квантовая механика говорит нам что электрон не может ни двигаться ни вращаться и находится одновременно везде по всей вселенной, однако снова ее игнорируем и считаем что электрон таки крутится вокруг ядра и одновременно вращается вокруг своей оси. Общее правило - в каждом квадратике электрона два, если электрон первым "заселился" в свой квадратик - его спин положительный, плюс. Если вторым - минус. (На самом деле первым может "вселиться" и минус, но спины у двух электронов в одном квадрате всегда противоположные.)
Собственно каждый элемент - можно записать либо номером (ака - весом) либо "адресом" последнего из его электронов. Второе по идее более важно, так как этот адрес показывает, как будет вести себя вещество.
К примеру адрес красной ячейки на картинке выше - 3d1+ (если в ней один электрон) или 3d1- (если два). Таким образом 3d1+ это другое название Скандия (вес/номер 21, гравитация -2, спин +), а 3d1- - Железа (вес/номер 26, гравитация -2, спин -).
Вариация таблицы Менделеева, показывающая адреса элементов на этажах-орбитах.
Далее идет описание волновой функции. Это опять же квантовая механика, если считать что электрон это не частица а размазанное в пространстве облако вероятностей то его поведение можно высчитывать как поведение волны (обычной, типо как на воде). При этом точно так же его можно высчитывать и как частицу, типо планеты, хотя и с оговорками. Короче квантовую механику продолжаем игнорировать.
Более того волновые уравнения настолько сложны, что поведение электронов на большинстве орбиталей никем до сих пор не высчитано. Собственно решение есть только для поведения одного электрона, и за неимением лучшего все пользуются им.
Так. Пока что в целом все понятно. Далее завтра.
Когда два атома поменялись электронами, то есть электроны одного находятся на орбитах вокруг ядра другого (при этом одновременно продолжая крутиться и вокруг ядра первого) - они среагировали друг с другом.
Любой элемент стремится забить незаполненный уровень чужими электронами, или наоборот отдать лишние свои. Я так понял, что если уровень забит меньше чем на половину - это можно воспринимать как "выступ в детальке паззла", то есть атом пытается присоединить лишние элементы в систему другого (такой атом называется донором). Если уровень забит больше чем на половину - то это "выемка в паззлинке" которую атом пытается заполнить чужими электронами (атом называется акцептором). Лучше всего реагируют атомы, выступы и выемки которых подходят друг к другу.
Чем уровень ближе к ядру - тем ядро сильнее держит электроны на нем, но одновременно тем сильнее пытается восполнить недостающие электроны.
В таблице Менделеева - первые два столбца это атомы доноры. Причем чем выше строка тем слабее донор.
3-5 столбцы это ни рыба ни мясо. Чем выше строка тем скорее акцептор, чем ниже - тем скорее донор.
6-7 атомы акцепторы. Чем выше строка тем сильнее акцептор.
8 столбец - атомы у которых полностью забит последний уровень, то есть они не желают вообще ни с кем реагировать.
(На самом деле не совсем, там ниже по тексту у меня более точный рисунок.)
Вещества из одного и того же столбца в целом похожи по поведению, но чем ниже они тем менее стабильны.
Таким образом самый стабильный элемент это гелий, самый яростный акцептор это фтор, а самые яростные доноры это все снизу списка.
Окей. Далее.
При нагреве вещества - его электроны ненадолго улетают на более далекие орбиты вокруг ядра...
(На самом деле не улетают а телепортируются, и вообще электрон не умеет двигаться он только и делает что телепортируется туда-сюда и вообще находится одновременно во всех вероятных точках своей орбиты и плюс еще вообще где угодно в мире но с меньшей вероятностью) - но это все квантовая механика, ее игнорируем.
Так вот - при нагреве электроны улетают на более далекие орбиты, и потом при остывании испускают свет (лишаясь энергии) и возвращаются на более близкие. Это фактически происходит при полураспаде радиоактивных веществ. Этот же процесс мы видим при нагревании металла - поэтому он светится - это электроны возвращаются с далеких орбит на ближние.
Видимый нашим глазом свет возникает при сваливании электронов с 5, 4 и 3 уровней на второй. При сваливании электронов на первый уровень - возникает более мощный ультрафиолетовый свет. При сваливании на третий - более слабый свет, при сваливании на четвертый - еще более слабый и т.д. (впрочем на четвертый уже почти ничего не сваливается, т.к. он далеко от ядра, и до него притяжение ядра доходит едва-едва).
Общий смысл химических реакций в том, что мы нагреваем вещество, и в результате выбиваем его электроны на более далекие орбиты (либо вообще выбиваем их куда подальше от атома). В далее когда электроны сваливаются назад - на свободные места вместо "своих" электронов (а так же вместе со своими электронами), могут упасть электроны, которые уже "прицеплены" к другому рядом пролетающему атому. Таким образом несколько атомов сцепятся в молекулу.
Если из атома вообще выбит один или несколько электронов, и вместо них ничего не свалилось, то есть места вообще вакантны - атом называется ионом. И тогда он начинает активно искать, чем бы забить недостающее место.
Энергия, необходимая, чтобы превратить атом в ион (то есть выбить нафиг его электроны) - называется энергией ионизации.
-
Далее небольшой отскок назад - к клеточкам.

Как говорилось ранее, каждая клеточка это два электрона. Если клеточки на любой строке забиты электронами целиком - то реагировать такое вещество вообще ни с кем не хочет и заставить его тяжело (высокая энергия ионизации).
Если забита только первая клетка из пяти - это значит магнитное квантовое число -2. Если только первая клетка из трех - число -1. Если третья клетка из пяти - число 0.
Чем магнитное число меньше - тем сильнее атом пытается отдать лишние электроны. Чем оно больше - тем сильнее он пытается притянуть недостающие электроны, чтобы получить себе полностью забитый электронами этаж. Точнее здесь по этой картинке получается что атом пытается получить полузабитые этажи... вобщем не важно, потом буду разбираться.
Далее спин. Условно считается что спин это вращение электрона, но опять же квантовая механика говорит нам что электрон не может ни двигаться ни вращаться и находится одновременно везде по всей вселенной, однако снова ее игнорируем и считаем что электрон таки крутится вокруг ядра и одновременно вращается вокруг своей оси. Общее правило - в каждом квадратике электрона два, если электрон первым "заселился" в свой квадратик - его спин положительный, плюс. Если вторым - минус. (На самом деле первым может "вселиться" и минус, но спины у двух электронов в одном квадрате всегда противоположные.)
Собственно каждый элемент - можно записать либо номером (ака - весом) либо "адресом" последнего из его электронов. Второе по идее более важно, так как этот адрес показывает, как будет вести себя вещество.
К примеру адрес красной ячейки на картинке выше - 3d1+ (если в ней один электрон) или 3d1- (если два). Таким образом 3d1+ это другое название Скандия (вес/номер 21, гравитация -2, спин +), а 3d1- - Железа (вес/номер 26, гравитация -2, спин -).
Вариация таблицы Менделеева, показывающая адреса элементов на этажах-орбитах.
Далее идет описание волновой функции. Это опять же квантовая механика, если считать что электрон это не частица а размазанное в пространстве облако вероятностей то его поведение можно высчитывать как поведение волны (обычной, типо как на воде). При этом точно так же его можно высчитывать и как частицу, типо планеты, хотя и с оговорками. Короче квантовую механику продолжаем игнорировать.
Более того волновые уравнения настолько сложны, что поведение электронов на большинстве орбиталей никем до сих пор не высчитано. Собственно решение есть только для поведения одного электрона, и за неимением лучшего все пользуются им.
Так. Пока что в целом все понятно. Далее завтра.
[ case study ]
.
[Print]
emergency